- 1SPLD论文笔记
- 2C++ 一直输入字符串,遇到enter键结束_持续输入消息直到回车键 c++ scandf
- 3应用实战|使用DBGate管理MemFireDB数据库_dbgate字段提示
- 4从零开始 | 原生微信小程序开发(二)_微信小程序原生开发
- 5安装anaconda、NLTK和jieba_jieba离线安装配置环境变量
- 6华为S2700-9TP-EI-AC SSH登录错误处理_华为 s2700 ssh invalid ket length
- 7嵌入式stm32毕设项目分享50例(四)_计算机嵌入式毕设
- 8Redis的Java客户端
- 913.2k star, 高生产力的低代码开发平台 lowcode-engine
- 10python utf-8 codec cant decode_python3使用beautifulSoup - UnicodeDecodeError: 'utf-8' codec can't deco...
创新生物药研发和生产过程中的数字化转型_生物制药数字化
赞
踩
创新生物药研发和生产过程中的数字化方案,对当前创新生物药的研发和生产过程中数字化转型的痛点,当前技术以及未来发展方向等多个层面进行剖析阐述:
01.创新生物药研发实验室的数字化合规要求
02.创新生物药数字化工厂计算机化系统合规要求
03.全球监管环境对数字化系统的要求
04.机器学习和云计算等新技术在创新生物药研发生产的应用
01/生命科学行业数字化大趋势
针对生命科学行业发展的大趋势,已经深入到基因和细胞的微环境和突破检测和新药研发的瓶颈阶段,2024年生物制品与生物药生产占比将超过50%,针对患者的个性化诊疗的兴起(细胞与基因治疗、CAR-T药物上市等)成为趋势。
很多企业客户面临着国内及全球法规的监管(如:中美双报),从国家“十四五规划”及二十大报告政策解读中不难看出,生命科学的数字化转型已经提升到国家战略发展层面的高度。创新生物药如何数字化,除了与化药一致的要求如:“成熟规模化生产工艺、GMP级别厂房设施、GMP级别质量管理体系”之外,创新生物药其产品生产特性“原辅料制备、靶点筛选流程、菌种库/质粒库/细胞库/种子库构建”,都属于创新生物药的生产工艺。

针对细胞与基因治疗,以及mRNA个性化肿瘤疫苗等个性化产品特殊性要求更高、更严格。例如对供者材料的安全性、生产工艺特殊性、生产批量小、温度敏感、易受污染或混淆等方面,这就对生产企业有了更高要求与挑战。
再加上mRNA疫苗和药物行业的另一大特性“靶点更新快、技术更新快”如何快速支持并符合标准,对于特别是研发生产领域、CDMO企业更需要从研发到生产全流程的数字化解决方案,实现数字化合规、端对端集成、柔性生产、降本增效等发展需求。
自动化与智能化是IT和OT(信息技术与物联网技术)的结合,实现机器数据到运营数据的快速探查和利用,基于机器学习实现质量预测与生产预警等重要功能。形成体量庞大的大数据如何解锁数据价值,基于大数据、机器学习等人工智能技术实现流程优化和科学决策。
02/生命科学企业数字化转型痛点
从2021年相关报告可以看出,目前企业普遍关注”信息安全相关建设、业务流程的重塑与梳理、应对业务变化的营销管理创新、基础架构的优化“方面,对于”数字中台、RPA、AI区块链技术、创新机制建立“等关注点都排在后边。
”保证合规性、减少合规成本、实现数据与信息追溯,实现数据集成与互联、解决信息孤岛等“还是当前生命科学企业现状,更多企业还是处于由纸质化办公往数字化办公的转型过程中,来解决以上问题。
从国际环境来看,很多企业已经引入云服务、机器学习、深度学习(如:R&D云服务软件应用)。机器学习在质量管理、实验室管理、研发生产管理等方面已广泛应用,如主动实验、生产质量智能化管理、主动的智能化排程、运营数据智能决策分析、数据预测性替代过去式、研发实验生产各类信息的归类和预测等,相信国内也会逐渐走向这个趋势。

03/生命科学信息化解决方案
百奥利盟致力于为全球生物药与精准医疗行业提供全程数字化解决方案,目前有100多项自主知识产权、全球300多个成功案例的落地实践,在美国、中东都设有分支机构,已经拥有十多年行业经验与积累。关注我们百奥利盟的客户伙伴们都知道,百奥利盟的英文logo从Bio-LIMS变更为Bio-TechLeague,代表着我们从实验室往生命科学行业整体数字化解决方案的转变。
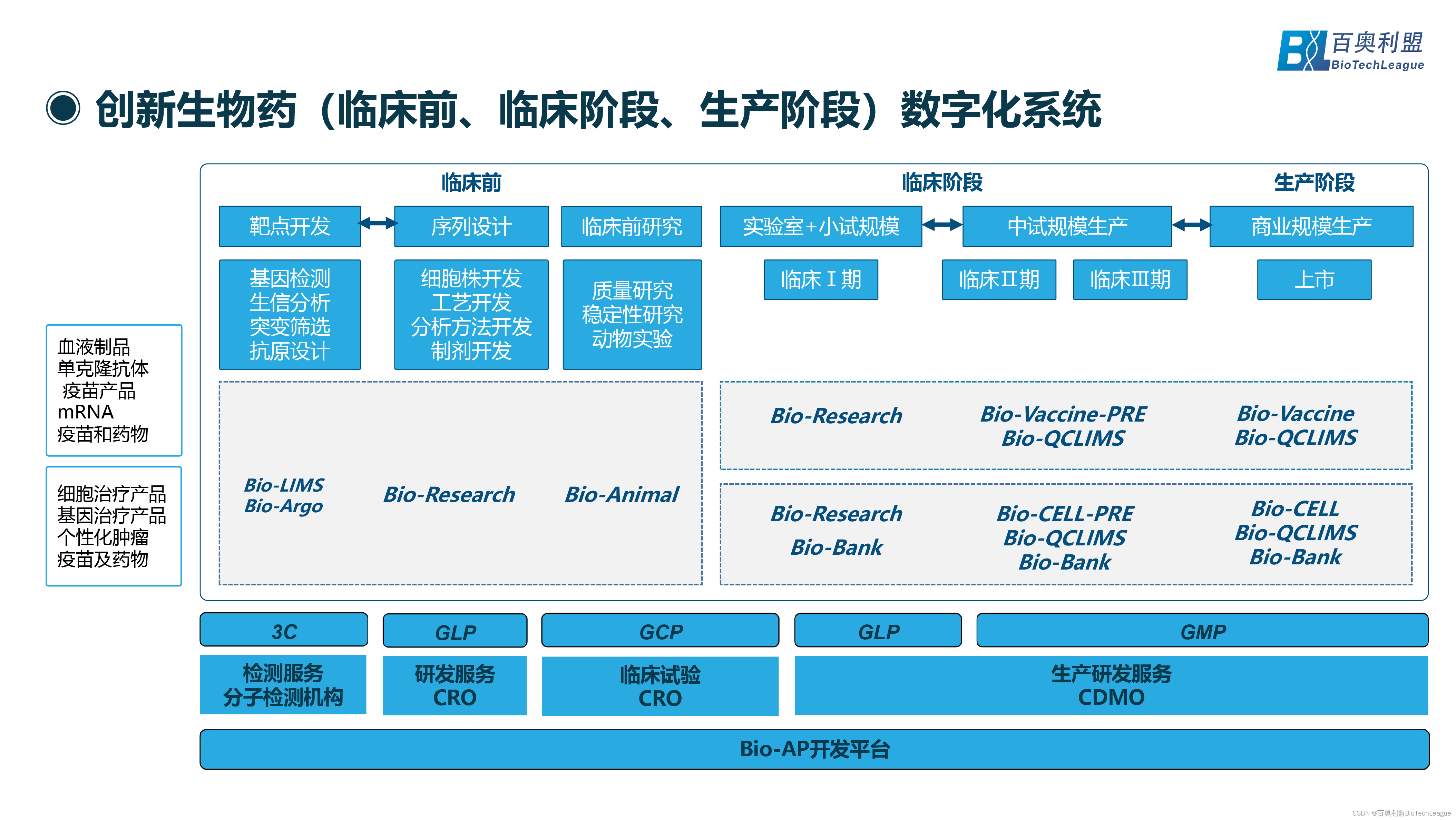
创新生物药(临床前、临床阶段、生产阶段)都需要怎样的数字化系统?首先针对生物制品行业或者生物药行业不同产品(如:血液制品、抗体、mRNA疫苗药物、个性化细胞与基因治疗、mRNA个性化肿瘤药物等)。
在临床前靶点开发阶段需要基因测序、生信分析、突变筛选、抗原设计等,可使用Bio-LIMS智慧实验室管理系统、Bio-Argo生物信息平台的系统产品来解决实验室以及生信分析等的数字化系统。在序列设计的各种实际开发,包括细胞株开发、工艺开发、分析方法开发、制剂开发等,都可以用Bio-Research针对研发实验室的数字化系统;
在临床前阶段质量研究、稳定性研究、动物实验等,可以用Bio-Animal动物实验数字化系统做支持。在临床阶段(实验室+小试规模、中期规模生产、商业化规模),百奥利盟创始人兼CTO倪总建议临床一期阶段还是需要研发相关的数字化系统,如Bio-Research研发实验室管理系统、Bio-Bank生物样本库管理系统。
在临床二期、三期规模增长后(特别是三期中试以后),在流程还未完全固定的现实情况下急需偏灵活的、生产相关的系统(生产前期的数字化系统)以及质控、样本库系统,如Bio-Vaccine-PRE疫苗生物药生产数据一体化信息平台-研发阶段、Bio-CELL-PRE细胞和基因治疗数据一体化信息平台-研发阶段、Bio-QCLIMS质控信息化管理系统、Bio-Bank生物样本库管理系统。
在商业化生产阶段,使用Bio-Vaccine疫苗生物药生产数据一体化信息平台、Bio-CELL细胞和基因治疗数据一体化信息平台、Bio-QCLIMS质控信息化管理系统、Bio-Bank生物样本库管理系统,从研发到临床到生产形成无缝衔接。
对于当前创新生物药领域,很多企业都处在创业阶段(即:中试、临床、生产中间阶段),确实需要相对轻量级、灵活性的,既符合生产标准要求,也符合灵活属性的数字化系统进行支持。对于各种企业CRO、CDMO等药企单位都面临着不同机构监管与法规规范要求。针对数字化系统一定要有一个技术开发的基础平台,不管是实验还是生产等环节都构建成模块化服务进行后期的组装。
04/数字化合规
专注于R&D云服务基础法规
▪ HIPPA(病人隐私信息保护法案)
▪ 中国人类遗传资源管理条例
▪ 21 CFR Part11(电子记录及电子签名法规)▪ 中国电子签名法
▪ ALCOA+CCEA原则(数据可靠性原则)GMP相关规范
▪ NMPA 2010年5月 GMP附录《计算机化系统》《确认与验证》
▪ NMPA 2020年2月 《药品记录与数据管理规范》
▪ NMPA 2020年7月 GMP附录 《生物制品》
▪ NMPA 2020年1月 《药品生产质量管理规范-细胞治疗产品附录》COI(身份链)COC(监管链)
▪ EU 欧盟药事法规第4卷GMP,附录11《计算机化系统》
▪ ISPE GAMP5-2 良好自动化生产实践指南,遵从GxP计算机化系统监管的风险管理方法
▪ ISPE PHARMA4.0
▪ WHO GMP 2003,Annex4实验室相关规范▪ GLP-计算机化系统的要求
▪ PCR临床实验室规范
▪ ISO17025(检验与校准实验室认证)
▪ ISO15189(医学实验室认证)
▪ ASTM E 2066(实验室信息管理系统的鉴定标准导则)
▪ ASTM E 1578(实验室信息管理系统(LIMS)的标准指南)
▪ CAP/CLIA(美国病理家协会实验体系认证)
▪ AAALAC(国际实验动物规范)
▪ AABB(生物样本库国际认证)
Gamp5 2.0
以纳入生命科学行业中新的和不断发展的主题例如:区块链、人工智能/机器学习 (AI/ML)、云计算和开源软件 (OSS)2022年10月31日,国家药监局核查中心正式发布了《细胞治疗产品生产质量管理指南(试行)》。全文十三章,涵盖细胞治疗产品GMP管理的基本原则、人员、厂房、设施与设备、供者筛查与供者材料、物料与产品、生产管理、质量管理、产品追溯系统等内容。
2022年10月31日,国家药监局核查中心正式发布了《细胞治疗产品生产质量管理指南(试行)》。全文十三章,涵盖细胞治疗产品GMP管理的基本原则、人员、厂房、设施与设备、供者筛查与供者材料、物料与产品、生产管理、质量管理、产品追溯系统等内容。
过十多年的不断创新与探索,已经形成了适用于实验室数字化服务以及生物药全生命周期数字化服务,可以根据不同客户的实际需求与发展阶段,进行模块化构建与组装。针对传统架构设备端、云服务、决策端等各种层级系统,解决数据传输效率低、无法实时数据探查等痛点问题。
工业4.0物联网扁平的数字化标准,实现了不同的系统都可以实时探查数据、减少成本,再加上创新生物药品种类多、流程各异、工艺升级快、技术平台多等实际问题,需要轻量级系统、功能与模块完整,支持灵活配置且快速上线与实施使用的信息化系统,为研究型中心医院、CRO+CDMO、分子检测、生物药研发生产等企业客户服务,助力创造更多实实在在的企业发展价值。
06/Q&A
Q1: 目前如在研发阶段,很多工序没有完全落实,如何规划信息化建设?
A1:创新生物药在研发阶段,主要进行临床前研究等工作,实验流程和生产工艺不确定,处于研发实验阶段,这时的痛点是如何快速记录实验信息,比较不同实验信息以及科学家一闪念的设计,需要采用研发实验室数字化系统。
Q2: 在IND阶段是否需要系统呢?如现在上系统如何为后续正式生产预留调整空间?
A:创新生物药在IND阶段有临床研究、小试、中试阶段,研发需要采用研发ELN电子记录本系统,到了中试阶段,既不属于研发,也不属于生产,需要有专门的数字化系统,然后再无缝转换到生产。
Q3:对于“基层数据与决策端数据扁平化的数字化管理”很认可,也特别注意到几个客户案例,想请问下像我们公司初创规模不是特别大,如何有步骤的进行数字化转型,我们也是聚焦细胞基因治疗领域,和医院有紧密客户订单协作,我们需要怎样的数字化管理框架和分阶段的具体部门/业务模块有次序的逐一部署?大概是怎样的周期,具体服务流程步骤是怎样的?谢谢
A:如果是初创型公司,可以统一规划,分布实施,按模块上线,比如细胞和基因治疗领域,可以先上线CDE法规最关注的追溯系统部分,再上线生产、质控、研发数字化模块,因为是分布上线,每期周期都不长。



