- 1Python 一网打尽<排序算法>之从希尔排序算法的分治哲学开始_希尔算法是分治
- 2玩转rk3588(七):GPIO简介及使用_rk3588 gpio
- 3查询飞书待办任务并直接完成任务代码(来自飞书官方,经测试可行)_
com.larksuite.oapi - 4消息中间件-kafka实战-第六章-kafka加线程池多线程消费_kafka指定线程池
- 5win10环境下git安装和基础操作_win10 git
- 6VHDL语言基础-基本语句
- 7AI实时绘画Krita+ComfyUi+lcm安装教程
- 8Spring框架第一篇(Spring概述与IOC思想)
- 9Nodejs学习_lowdbjs
- 10MySQL数据库——多表查询(1)-多表关系(一对多、多对对多、一对一)、多表查询概述(概念、笛卡尔积、分类)_一对多的表,如何关联查询
共聚焦显微镜中荧光团的共定位_confocol 共定位
赞
踩
在多标荧光样品图像中,因两个或多个荧光团在显微结构中距离很近,经常会有发射信号叠加,这种效应就称为共定位。目前,高特异性合成荧光团和经典免疫荧光技术的应用、精密光切技术的应用、共聚焦和多光子显微镜提供的数字图像处理技术等大大提高了生物样品中共定位检测的能力。
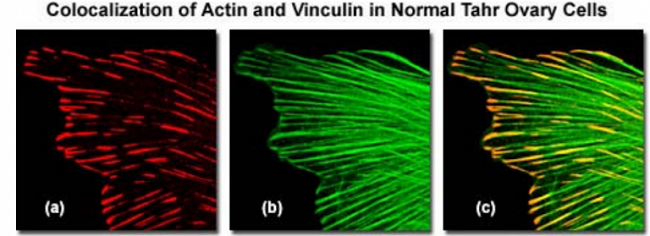
图 1
共定位在生物表述上是这样定义的:两个或多个不同的分子位于样品上同一个物理位置。对显微镜中看到的组织切片、单个细胞或亚细胞器官,共定位意味着不同的分子连接到同一个受体上;在数字图像方面,这个术语指的是不同荧光分子发射的颜色分享图像中的同一个像素。在共聚焦显微镜中,样品被记录成含有很多像元的多维阵列数字图像,每个像元代表一个三维像素。像元的尺寸(或检测单元)由物镜的数值孔径、照明波长以及共焦检测针孔直径等决定。因此,在一个样品中两个荧光探针的共定位,比如发绿光的 Alexa Fluor488,发橘红色光的 Cy3,在图像中就是由含有红色和绿色两者贡献的像素表示(经常产生各种各样的橘色和黄色)。
举一个例子, 图 1 的一系列图表明了骨骼肌动蛋白和黏着斑蛋白侧向光学平面上的共定位(激光扫描共聚焦显微镜中的 XY 面)。这些共定位点可作为肌动蛋白丝的成核位点,也可作为外部介质、质膜和肌动蛋白骨架之间的交联剂。图 1( a)是 Alexa Fluor 568 通道(目标对象是黏着斑蛋白),由 543nm 的氦氖激光器激发;而 Figure1( b)是 Alexa Fluor488 通道(目标对象是丝状肌动蛋白),由 488nm 的氩离子激光器激发; Figure1( c)是前面两幅图的叠加,表明两种荧光信号在丝状肌动蛋白纤维末端的共定位。必须指出的是,共定位并不指的是具有相似发射光谱的荧光团出现在合成图像的同一个像素上。准确的共定位分析只有在荧光团的荧光发射光谱足够分离且滤色片(或光谱狭缝宽度)正确设置的情况下才有可能。荧光团发射光谱之间的大量叠加或滤色片组合的不正确使用,都可能导致光谱串色,这种情况下共定位的测量就没有意义。为了避免产生共定位假象,荧光团必须与照明光源的光谱认真匹配(共聚焦中是激光线),来获得最大激发效率,同时在发射光谱之间保持一定的分离度。在大多数情况下,对共定位分析来说,荧光团的选择对获得满意结果极为重要。
在图 2 中,对 Alexa Fluor 染料家族的光谱叠加作了比较,这在共定位实验中是很有用的。为了比较,所有的发射光谱都做了归一化,叠加区域用灰色阴影显示。在图 2(a) 中,绿色荧光染料 Alexa Fluor 488 和橙黄色荧光染料Alexa Fluor 555 在峰波长处显示很明显的分离,人眼也很容易能够区分。然而,光谱叠加(灰色阴影区域)表明在 Alexa Fluor 555 的发射峰上很明显有 Alexa Fluor488 的发射光谱(用一条黑线标示,从发射峰到横坐标)。当 Alexa Fluor 488 的荧光发射强度明显比 Alexa Fluor 555 的荧光发射强时,荧光信号这么高程度的串色使得荧光探针的分离很难。很多因素都会导致这种情况发生,比如荧光团标的物浓度的巨大差异。因此,在共定位实验中,这些探针的组合就应该避免,或只有当图像在多通道共焦模式采集下才可以使用,这样可以降低或消除串色。

图 2
Alexa Fluor 探针之间的光谱叠加程度会随着探针发射峰之间的距离增加而下降,如 Figure2(b)所示。在这种情况下, Alexa Fluor 488 和深红色染料 Alexa Fluor 633 与 Figure2 (a)比较,重叠区域明显降低。这两种染料人眼都很容易区分,光谱重叠程度低在共定位实验中可使串色最小化,如每个探针的浓度相似的话,应该可以产生较好的结果(注意:深红色的荧光染料 Alexa Fluor 633 在低浓度时通过显微镜目镜很难观察到)。 Alexa Fluor 633 可被红色氦氖激光器的 633nm 线最有效的激发,也可被黄色氦氖激光器的 594nm 激发。或许,在 Alexa Fluor染料发射的可见光区域,最好的光谱分离是 Alexa Fluor 488和 Alexa Fluor 647 的结合(图中未显示)。实际上,在这些染料之间没有光谱重叠,即使样品含有过量的 Alexa Fluor 488,应该也没有串色。具有这些特点的荧光探针是共聚焦显微镜分析共定位的理想选择。
在共聚焦显微镜中,测定共定位的能力受限于光学系统的分辨率及用于照明样品的入射光波长。宽场荧光和共聚焦显微镜理论分辨率约为 200nm,但在实际上,由于各种原因这个数降到 400nm 和 600nm 之间,原因包括显微镜光路未完全对准、光学折射率波动、光学像差及样品制备的不合适。然而,对于一个已经完全调好的共聚焦显微镜来说,两个荧光分子是否连接到同一个目标对象上,或者它们是否定位在同一个器官上受光学分辨率影响。共定位的许多实验是围绕高特异性的合成探针和抗体进行的,标记目标是容易区分的局部的、明确的细胞结构。
对于厚度小于 5μm 的样品,比如贴壁细胞或很薄的组织切片,在常规的宽场荧光显微镜下,定量的共定位分析一般是可以的。然而,对于厚样品,图像应以具有一定轴向尺寸的光学切片来记录,来分析看起来共定位的荧光团是否真正位于同一个侧向焦平面上,或在 Z 轴上他们是否彼此叠加。厚样品的荧光团共定位分析应通过获得薄的光学切片来进行,可用激光扫描共聚焦显微镜、或转盘共聚焦显微镜或多光子显微镜。多光子显微镜经常用单个近红外激光,在物镜焦点处的特定区域激发双标样品的两个荧光团。这些技术将荧光发射局限在仅位于焦平面上的荧光团,这样大大降低了光漂白和背景噪音。
共定位的软件分析
样品中荧光团共定位的程度是通过比较一幅图上每个像素位置的颜色值测定的。分析的第一步就是要显示进行共定位测量的图,一般以两个独立通道的合成图显示。当分析多标样品时,在一次计算中,只能处理两种伪彩,但所有伪彩排列之后都可以配对用于共定位分析。由于传统上使用氩离子激光器、氪-氩离子激光器及氦氖激光器,这些激光器能够有效地激发在蓝色和绿色区域有强烈吸收的荧光团,因此选择红绿颜色对作为共聚焦荧光颜色。此外,人眼对绿色和红色色调更为敏感。
图像的共定位分析一般经常用散点图表示( scatterplot),这个图将两套数据关联起来。散点图以二维图的形式描述了一幅图或一个感兴趣区域每个像素处一个通道对另一个通道的强度值(见图 3 和图 4)。作图时其中一个通道(通常是绿色)作为 x 轴,而另一个通道(通常是红色)作图时作为 y 轴,在横坐。标和纵坐标上强度范围是 0∼4095. 因此,合成图的每个像素点都有一对强度值。分析每一对强度值产生的分布图案,能够识别荧光团的共定位、区分背景、串色、光漂白等。
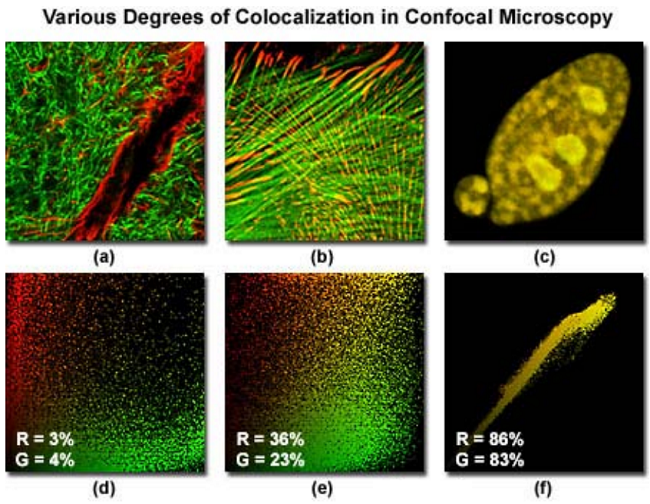
图 3
图 3 描述了共聚焦的三个合成图(伪彩为红色和绿色),以及对应的散点图,三个样品荧光团共定位的程度不同。每个通道中强度很低的像素位于靠近散点图的( 0,0)处,而越亮的像素分散得越远。在连接红色通道和绿色通道的散点图中,纯的红色和绿色的像素点往往会团聚在轴位置。而共定位的像素(如果有的话)看起来是彩色的,具有黄色和橙色的色调(取决于共定位的程度),落在 y=x位置附近,也就是散点图的右上角。
图 3a 显示的样品为鼠脑冠状位海马切片,用 Alexa Fluor488 标记神经纤维,Alexa Fluor568 标记神经胶质原纤维酸性蛋白, GFAP。在图 3b 中,印度麂鹿皮肤成纤维细胞用 Alexa Fluor568 染色,标记对象是黏着斑蛋白,同时用 Alexa Fluor488 与鬼笔环肽作用,标记对象是纤维状的肌动蛋白。而表达了荧光蛋白DsRed 和 EYFP 的兔肾上皮细胞,定位在核上,在图 3c 中描述。相关的散点图直接位于样品图像的面,例如图 3d 是图 3a 的散点图,两个通道共定位的程度在每个散点图的左下角用白色字母和数字表示。图 3a 共定位程度相对较小(只有百分之几),在图 3b 和图 3c 中共定位程度逐渐增加,共定位系数分别是 30%和85%。
共聚焦显微镜及配件制造商提供的软件可对荧光团共定位进行散点图分析。图 4 显示了一系列分析图,这个图是印度麂鹿皮肤成纤维细胞,用 AlexaFluor568 染色(标记对象是黏着斑蛋白,红色通道),同时用 Alexa Fluor488染色(标记对象是纤维状肌动蛋白,绿色通道)。在散点图中选择一个感兴趣区域进行分析,在图 4a 中用白颜色的长方形为这个感兴趣区域设定了信号的阈值,大多数共定位分析软件都可以进行这种功能分析。
感兴趣区域的水平边界和竖直边界应该排除背景信号,背景沿着散点图的 x轴和 y 轴团簇。只有被包括在所选择区域边界内的像素信号才能进行共定位分析。样品上重叠的像素区域很容易转变成共定位二元阈值像(图 4b),这个图还可以和共聚焦图叠加在一起,做一个共定位 map. 图 4c 显示的共定位 map 图用白颜色显示了共定位区域,对大多数软件这个颜色很容易变成其他颜色,相对于原来的伪彩,对比度更高一些。

图 4
正如上面所讨论的,在共聚焦图中对荧光团共定位的定量测定,可通过散点图和感兴趣区域的信息获得。从整个散点图的信息,可获得很多变量值。Pearson′s 系数就是用于分析整个散点图的诸多变量中的一个,为描述两幅图之间重叠程度,在识别一幅图像和另一幅图像的匹配程度上, Pearson′s, R(r)系数是标准技术之一。 Pearson′s 相关系数根据下面方程计算:

S1 是第一个通道每个像素的强度值,而 S2 是第二个通道每个像素的强度值。S1(average)和S2(average)分别是第一个通道和第二个通道平均像素强度值。在 Pearson′s 系数里,原始像素强度值减去平均像素强度值。结果,系数值范围从-1到 1, -1 表示图像的像素之间完全没有重叠,而 1 表示完美的图像重叠。Pearson′s相关系数只解释了两个图像之间形状的相似性,而与图像像素强度值无关。然而,当把这个系数值应用到共定位分析时,潜在的负值难以解释,需要用另一种方法解释结果。
用于计算另一相关系数的较简单的技术,需要去掉原始像素强度值和平均像素强度值这个差减项。 正式定义为 Overlap 系数( R) ,这个值范围从 0 到 1,在图像分析中对强度变化不敏感。 Overlap 系数定义为:

分子是两个通道强度的乘积和,只有当同一个像素的两个通道值与共定位相关时,分子才会给出一个很有意义的值(两个通道的像素强度值都大于 0)。因此,方程( 2)的分子与共定位的像素数成正比。同理, Overlap 方程的分母正比于图像两个通道组分的像素数,而不考虑共定位是否存在(注意:组分定义为通道 1 和通道 2 红颜色和绿颜色的图或像素阵列)。 Overlap 系数的一个主要优点就是对一个图像上各种组分的信号强度差相对不敏感,信号强度差经常是由荧光团的浓度差、光漂白、量子效率变化及非等效的电子通道设置等产生的。
使用 Overlap 系数最重要的缺点是:通道之间组分像素数比例会强烈影响Overlap 系数值。为了减少这种依赖性, Overlap 系数分成两个不同的子系数,看 k(1)和 k(2),以两个独立的参量来表达共定位的程度。

Overlap 系数 k(1)和 k(2)描述了通道之间强度的差异, k(1)对通道 2(绿色信号) 强度差敏感,而 k(2)线性依赖于通道 1 像素的强度值。因此,现在描述的方程能够说明重叠度,也能解释颜色通道之间的强度差异。在图像的共定位区域,为了估计其中一个颜色通道对整个共定位荧光的贡献,定义了另外一套共定位系数 m(1)和 m(2)。

共定位系数 m(1)用于描述通道 1 对共定位区域的贡献,而共定位系数 m(2)用于描述通道 2 对共定位区域的贡献。注意,如 S2(i)大于 0 时,变量 S1(i,coloc)等于 S1(i);对于变量 S2(i,coloc)也是这样的。相对于每个荧光通道的总荧光量来说,这些系数正比于 merge 图像中每个荧光通道共定位荧光团的荧光量。即使当两个荧光通道的信号强度明显在不同的档次,共定位系数 m(1)和 m(2)也能测定。
另一对共定位系数可对散点图上定义的感兴趣区域内像素强度范围进行计算。系数 M(1)用于描述通道 1 荧光团对共定位区域的贡献,系数 M(2)用于描述通道 2 荧光团对共定位区域的贡献。

式中,如 S2(i)位于感兴趣区域阈值范围内, S1(i,coloc)等于 S1(i);如 S2(i)代表的像素在感兴趣区域阈值外, S1(i,coloc)等于 0.相似地, 如 S1(i)位于感兴趣区域阈值范围内, S2(i,coloc)等于 S2(i);如 S1(i)代表的像素在感兴趣区域阈值外, S2(i,coloc)等于 0. 换句话说,对每一个通道来说,分子代表这个通道所有像素(且每个像素在另一个通道也有强度值)的强度和,而分母代表这个通道的所有像素的强度和。相对于每个通道的总荧光量来说,这些系数与每个通道共定位对象的的荧光量成正比。
大多数商业共定位分析软件都能计算上面所描述的参数,包括 Pearson′s 相关系数、总 overlap 系数以及 k(X), m(X)和 M(x)共定位系数。此外,许多分析软件包含的算法可进行背景校正,产生整幅图的散点图,且可在一个双通道合成图或共聚焦图的感兴趣区域进行计算。从这些软件中获得的最重要的数据就是共定位系数,这意味着信号之间重叠的相对程度。例如,通道 1 的荧光团共定位系数为 0.75 意味着通道 1 中含有通道 2 组分的强度值占通道 1 总的强度值是 75%。这是一个相对比较高的共定位程度。同样地,对通道 2 共定位系数为 0.25 意味着明显降低的共定位。
共定位分析中的假象及样品考虑
共定位分析遇到的一个最重要的问题就是由发射光谱叠加、自荧光(主要存在于组织样品)、非特异性抗体或合成荧光染料染色引起的光谱串色。荧光共振能量转移对于光谱有叠加的共定位荧光团来说也是一种潜在的假象。当观察标记有绿色、红色荧光探针的样品时,任何这样一种假象都能产生看起来是黄色或橙色的像素,但这种颜色并不来自共定位。
当对两种或两种以上荧光染料标记的样品进行成像时,最常见的问题就是荧光串色问题。例如,当用传统的绿色和红色荧光探针荧光素和罗丹明进行双标时,串色只有用最优的荧光滤色镜组才能降低,但绝不会完全去掉。这是因为这样一个事实:这些染料都有很宽的吸收和发射光谱,光谱之间有明显的重叠。因此,激发荧光素的氩离子激光器的 488nm 线也能激发罗丹明,尽管激发程度较低。而且,在为罗丹明预设的光电倍增管通道或宽场滤色镜套组中也会检测到荧光素的荧光发射,甚至在没有共定位的地方,产生看起来是黄色或橙色的像素。要用这些染料或类似染料进行共定位实验时,串色问题必须完全消除。
成探针克服,比如 Alexa Fluor 系列或 Cy 系列染料。这些专门设计的有机分子表现出很窄的发射光谱(与传统探针相比)、与弧光灯和激光线相匹配的较大的吸收系数、较高的量子产率、降低的光漂白,且荧光发射对环境变量的依赖性较低。此外,这些先进探针的激发光谱线横跨大约 400nm,从紫外到近红外有一个很宽的选择,以匹配照明光源,使得发射光谱叠加最小。
自发荧光(对甲醛固定的组织样品尤为显著)产生的问题在表现上与串色类似。有自发荧光的样品激发后经常会在其他通道检测出荧光发射,使得到的照片看起来有共定位荧光团。如用抗体和合成荧光团对背景过度染色,也会在两个荧光团非特异性标记明显的地方产生看起来像共定位的图像。这个假象可以通过认真地制备样品、用合适的 control 监测实验方案来避免或明显降低。
只有当所有的串色、自发荧光、非特异性荧光问题都消除掉后,共定位的研究才是准确的。在激光扫描共聚焦显微镜中,最有效的方法就是利用序列激发,并用窄的带通发射滤色片或窄的狭缝宽度(光谱型)收集发射荧光。同时,应该检查单标的 control 样品,以确保完全消除了串色,未染色的 control 在监测自荧光方面是很有效的。

图5
激光扫描共聚焦显微镜中各种样品串色的问题及其校正在图 5 中显示。图 5( a)中的纤维原细胞, Alexa Fluor488 绿色荧光串色进入 Mito Tracker 红色通道,当样品用 488 激光和 543 激光同时扫描时,会产生黄色的肌动蛋白丝。序列扫描和检测(图 5d)消除了串色影响。同样地,在用 Cy3 和核探针 DRAQ5 对老鼠大肠厚切片进行同时扫描时(图 5b),也会发生串色。序列扫描可以去掉串色假象(图 5e),而串色假象会造成虚假的共定位。
当多标样品用两种以上的激光扫描时,串色问题在好几个通道都会观察到,图 5( c)和图 5(f)显示了鼠脑的一个厚切片,用 Alexa Fluor488 标记神经丝、用 Alexa Fluor 568 标记神经胶质纤维酸性蛋白(GFAP),用 DRAQ5 染核。当样品同时用 3 个激光扫描时(图 5c),串色会在第二和第三个通道发生,在样品的中间丝里就意味着有可能的共定位。然而,若开始用序列扫描并收集数据时,神经丝只出现在它们各自的通道里(图 5f),消除了这些结构中荧光团共定位的可能。荧光共振能量转移(FRET),理论上可以测量位置离得很近的两个荧光团的距离,也是监测共定位的一个潜在有用的工具。然而,在共定位分析中这个现象经常会导致一些假象,除非在实验的设计过程中,对 FRET 的一些参数做了很好地理解并认真进行了考虑。尤其是在第一个荧光团的发射光谱和第二个荧光团的激发光谱重叠的地方,研究者应该特别关注。这些样品中的能量转移表现为:第一个荧光团的荧光发射意外地降低同时伴随着第二个荧光团的荧光发射意外地增加。紧密相关的荧光团之间的相互作用可导致发射荧光信号的淬灭,这与环境条件有关。
共定位分析中许多潜在的问题都可通过仔细关注样品制备技术来规避。正如上面讨论的,荧光探针应该选择发射光谱分离比较大的且具有最小叠加的组合。如果可能的话,选择绿颜色的具有窄发射的荧光团(比如 Alexa Fluor 系列或量子点)及红颜色的在深红区或近红外区有发射的荧光团。原发性和继发性抗体必须检测交叉活性及非特异性背景染色。合成荧光团及标记的继发性抗体的浓度应该优化以确保相似的亮度,尤其是当对象丰度根本不同时。影响荧光团亮度的因素包括激发效率、量子产率、消光系数、浓度及环境因素,如 pH值、离子浓度、疏水性及粘性。对每一个荧光团都应单独制备 control 样品,在不染色的情况下,分别分析串色和自荧光。仔细注意着色过程中的微小细节,就会降低使用图像处理软件恢复数字图像的必要性。
共定位分析的实际情况
在分析复杂的荧光图像时,使用伪彩色组合很有用,这在上面已经讨论过了。通常,选择两个彩色通道,最常用的是绿色和红色。因此,叠加区域显示黄色。其他颜色对,比如蓝色、绿色(产生青色),蓝色、红色(产生紫色)也会用到,但因为反射的蓝光对人眼灵敏度低,这些颜色对在实际观察中很少使用。但在许多情况下,尤其是三色图像,不可避免会使用蓝色伪彩色。
采集图像及显示参数方面,应该采用一种标准以便使合成图对每一个荧光信号显示同样的动态范围和补偿。事实上,标准的共聚焦显微镜操作将这种方法视为日常样品分析方法。两个图像 merge 时,如果收集到的光子足够,叠加的红色绿色信号就会产生明确的亮黄色。在光子极少的实验中,共定位荧光团会产生暗黄色,而对背景具有相同贡献的绿色和红色会显示棕色。
每一个通道的 offset 和 gain 都应该单独调节(设置背景为 0,饱和为 4095),以便每一个荧光团都显示在完整的 12 位范围里。然后,对每个图像进行单独处理。尽管这是采集和显示多色图像的一个很方便的方法,但样品中两个信号的实际相对强度没法测定,因为每个信号的采集都是为了满足整个 12 位的图像深度。因此,某一个颜色通道相对信号强度的分析要求各个通道以同样的采集参数配置,比如光电倍增管电压、增益和补偿等。
如果图像采集和图像处理技术没有平衡好,在 merge 的彩色图中,就会由于采集过程光电倍增管不合适的 Gain、 offset 配置及图像处理过程中强度直方图的极端拉伸而对共定位做出不准确的解释。举个例子,如果 offset 值过高,就会发生很明显的颜色分离,在低 offset 值下,在同样的结构下,观察到的对比度就降低。对于一些关键应用, ratio 成像技术可用于区分两个信号是共定位还是只是部分叠加。

图6
对完全校准好的荧光成像系统,当用不同的滤色镜组时,样品上一个点在检测器上精确成像为一个点,也就是像素对像素。然而,不同颜色的通道 merge 时,物镜的色差校正不够、滤镜光路没有完全对准都会使得荧光信号之间的记录有差错。对具有复杂图案的图像或明暗信号相混的图像,这个可能就检测不到。会得出这样的结论:在结构中的信号分布要么是明显不同,要么是部分叠加的。
在 merge 图像的处理过程中,位移问题可用许多软件包通过 panning 操作恢复原始记录。通过 panning 操作校正一系列不同颜色图的过程中,需要样品上有一个固定的参考点,这个参考点在每一层图上都有。如不存在多标的样品参考点,就将多色的荧光微球稀释后加入样品中,用盖玻片进行封装前,在每个视野中都会有几个珠子。对于一些苛刻的应用,几个带通二色镜和发射滤色片可与不同的激光器或荧光团特定的激发滤色片一起使用。这种滤光镜组的配置一般用在共聚焦显微镜中,当对颜色校正要求苛刻时,也可用于宽场荧光显微镜。
图 6 显示了上面讨论的几个常见问题,多标样品(注意:图 6 中所有荧光团都只显示绿色和红色两种伪彩)经常会妨碍共定位的准确分析。用增强黄色荧光蛋白融合过氧化酶转染人类女性骨肉瘤上皮细胞,目标对象是缩氨酸序列(发绿色荧光),随后用免疫荧光的方法,用二次抗体标记 Alexa Fluor568(发红光),目标对象是过氧化酶膜蛋白( PMP-70),显示在图 6( a)和图 6( d)中。图 6( a)中的背景太黑,致使标记的黄色荧光蛋白强度降低。这种错误使共定位分析发生偏移,对绿色通道中重叠的像素人为产生了较低的检测量。合适的图显示在图 6( d),显示了明显较高的共定位程度。
猕猴肾上皮细胞的线粒体网络用 EYFP 和 HcRed1 荧光蛋白(此蛋白含有缩氨酸序列,目标对象是线粒体)转染。成像过程中,非常亮的 EYFP 大大地遮盖了HcRed1 发射的荧光信号,当检测通道的电压、增益和补偿值接近时, HcRed1 发射的荧光信号比 EYFP 要弱几乎 100 倍(图 6( b))。调整 HcRed1 通道 PMT 的值可平衡荧光蛋白的发射强度以克服这种差异,共定位程度明显增加(图 6( e))。图 6( c)显示几个叠加通道重合不好,图中显示的是塔尔羊卵巢细胞,用 AlexaFluor488 耦合鬼笔环肽染色(目标对象是绿色丝状肌动蛋白),用 Alexa Fluor568二次抗体染色,目标对象是粘着斑蛋白抗体(粘着斑)。肌动蛋白丝末端应该与样品中粘着蛋白共定位,但在图 6( c)中,他们没重合好,正如在图像右下角用红色和绿色荧光团标记的微球重合不好一样。采集完图像后,进行图像处理可将通道对齐,恢复图像的位置(也就是球的位置),为共定位分析提供了很好的样本。
结论
当研究荧光团共定位时,要考虑的最重要的一点是:确保样品标记的质量最好。抗体和合成荧光团都应进行特异性的分析和选择,背景要低、没有交叉活性。为了降低串色影响,发射光谱分得比较开的荧光探针组合最适合做共定位实验。要做合适的 control 实验,包括用每个探针单独标记样品及未标记的只有自发荧光的样品,都应该制备,而且在真正的实验条件下细致地观察串色。样品制备好后,仪器和软件的参数都要关注。有一点很重要,要记住:样品制备得不好并不能通过数字图像处理技术克服。在大多数情况下,优化染色条件会节省大量的时间,最终产生较好的结果。
进行共定位分析还取决于仪器的配置要求,需要最高质量的消色差显微镜物镜,这对于降低色差是很必要的,色差会影响共定位的定量计算。许多生产产商引进了平场复消色差物镜,这种物镜对色差在整个可见光范围内( 400-700nm)进行校正,可明显有助于荧光显微镜的定量研究。所有的荧光发射滤色片都应该用与荧光团发射光谱匹配的带通透射来优化。这是控制样品中其他荧光团串色最重要的考虑之一。如果在 control 样品中检测到串色(用单一探针染色或未染色只有自发荧光),用装有 AOTF( acousto-optic tunable filter)的显微镜进行多通道序列扫描会产生最优的结果。
参考文献
1. Olympus Microcopy resource center
2. HandBook of Biological Confocal Microscopy (THIRD EDITION) James B.Pawley
科学指南针为您提供材料测试,主要业务范围包括XPS,普通XRD,透射电子显微镜TEM,全自动比表面及孔隙度分析BET等测试。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。
更多科研资讯干货,可点击下面链接获取哦~


